|
| Allgemeines Phosphatidylserin (PS) findet sich normalerweise auf der Innenseite der
Zellmembran einer lebenden Zelle. Während der Apoptose (dem "programmierten
Zelltod") wird PS auf die Außenseite der Membran transloziert. Annexin V bindet
sich an PS. Durch Markierung von Zellen mit FITC-Annexin V kann man apoptotische
Zellen durchflusszytometrisch nachweisen.
Werden Zellen nekrotisch und ihre Membran durchlässig, kann
FITC-Annexin V in die Zellen eindringen und sich an die Innenseite der Membran
binden. Daher können bei alleiniger Färbung von Zellen mit FITC-Annexin V
apoptotische nicht von nekrotischen unterschieden werden.
Man kombiniert daher die FITC-Annexin V Markierung mit einer
Propidiumiodidfärbung. Das Propidiumiodid (PI) dringt nur in Zellen mit durchlässiger
Membran, also in nekrotische Zellen ein.
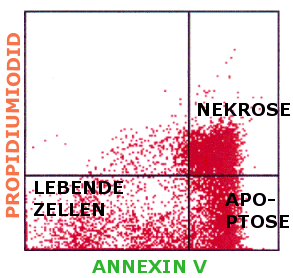
Lebende Zellen sind daher Annexin-negativ und PI-negativ,
apoptotische Zellen sind Annexin-positiv und PI-negativ, nekrotische Zellen sind
Annexin-positiv und PI-positiv (siehe Abbildung).
Methode: Wir haben zwei Kits (von der Firma Beckman-Coulter und von
Boehringer Mannheim) für die Messung von Apoptose und Nekrose von Zellkulturzellen (Linie
monozytäre Zelllinie) unter der Einwirkung eines Zellgiftes und eines Antioxidans
eingesetzt.
Ergebnisse: Mit beiden Bestimmungskits gab es reproduzierbare und
miteinander vergleichbare Ergebnisse. Unterschiede in der Durchführung der Tests oder im
Preis könnten für den einen oder anderen Test sprechen.

|
| Annexin-V-Fluos
(Böhringer Mannheim / Roche) Boehringer Mannheim
Best. Nr. 1 828 681
250 Bestimmungen
Prinzip:
In frühen Apoptose-Stadien finden Änderungen der Zellmembran
statt, u.a. die Translokation von Phosphatidylserin (PS; ist normalerweise nur auf der
zytoplasmatischen Innenseite der Membran loklaisiert) auf die Außenseite der Membran.
Makrophagen können Phosphatidylserin erkennen, das während der Apoptose an der
Oberfläche von Lymphozyten exponiert wird. Das Erkennen und die Phagozytose von
apoptotischen Zellen sowie apoptic bodies schützt den Organismus vor der Exposition
zellulärer Proteasen, die bei Nekrose freigesetzt werden und zu Entzündungen führen.
Annexin-V ist ein Ca2+-abhängiges,
Phospholipid-bindendes Protein mit einer hohen Affinität für Phosphatidylserin. Dieses
Protein kann somit als empfindliche Sonde für die Phosphatidylserin-Exposition auf der
Membranaußenseite aller exprimierenden apoptotischen Zellen eingesetzt werden und ist
deswegen zur Detektion apoptotischer Zellen in Zellgemischen geeignet (cave: nicht auf
Gewebsschnitten!).
Da nekrotische Zellen durch den Verlust der Membran-Integrität
(permeabilisiert) ebenfalls Annexin binden, allerdings schon über dem Apoptosestadium
hinaus nekrotisch sind, empfiehlt sich eine Differenzierung der apoptotischen von
nekrotischen Zellen durch die Anwendung eines DNA-Farbstoffes, der nur die
permeabilisierte Membran nekrotischer Zellen passieren kann, z.B. Propidium-Iodid. Die
gleichzeitige Anwendung von Annexin-V-Fluos und PJ gestattet die Diskriminierung
nekrotischer Zellen im Annexin-V positiv gefärbten Zellcluster.
Annexin-V (rekombinant) wird in Saccharomyces cerevisiae
("Bäckerhefe"; Stamm TR 1635) produziert. Das Protein wird nach
Ammoniumsulfat-Fällung über Phenyl-Sepharose und Heparin-Sepharose gereinigt, Größe
ca. 37 kD, pH 4,73
Lösungen:
- Inkubationspuffer: Herstellung einer Lösung, die 10 mM
Hepes/NaOH, pH 7,4, 140 mM NaCl, 5 mM CaCl2 enthält
- Propidium-Iodid-Lösung
: Stammlösung mit 50 µg/ml
- Annexin-V-Fluos-Markierungslösung
:
= > 20 µl Annexin-Stammlösung + 1000 µl Hepes-Puffer + 20 µl PJ
Färbeprozedur:
- 106 Zellen/ml mit PBS waschen und bei
200 x g 5 Minuten zentrifugieren
- Zellpellet mit 100 µl Annexin-V-Fluos-Markierungslösung
resuspendieren, 10 – 15 Minuten inkubieren
- 5 Minuten bei 200 x g zentrifugieren, Überstand
abgießen
- Zugabe von 0,4 ml Inkubationspuffer und Analyse am
Durchflußzytometer
(488 nm Exitation, 515 nm Bandpass Filter für Fluorescein-Detektion, Filter
> 560 nm für PJ-Detektion)
- Settings FACS-Calibur:
Det.VoltageAmpGainMode
FSCE001,00Lin
SSC3501,20Lin
FL14861,00Log
FL25061,00Log
Threshold:
FSC 20
Compensation:
FL1 - 0,0% FL2
FL2 - 31% FL1

|
| Annexin-V-FITC
(Beckman Coulter) Best. Nr. IM2375 - 20 Bestimmungen
Best. Nr. IM2376 – 200 Bestimmungen
Der Annexin-V-FITC Kit ist ein sehr sensiitver Test zur Detektion von früher Apoptose
in lebenden, nicht fixierten Zellen. Er beruht auf der Bindung von Annexin-V an
Phosphatidylserin in Kombination mit Propidium-Iodid.
Der Zeitaufwand ist gering und der Ansatz kann sowohl am Durchflußzytometer wie auch
mit dem Fluoreszensmikroskop analysiert werden (cave: nicht in der
Immunhistochemie/Gewebsschnitten einsetzbar)
Lösungen:
- 10-fach konzentrierter Puffer
: 1,7 ml, flüssig
1:10 mit A. dest verdünnen, im Kühlschrank lagern
Propidium-Iodid-Lösung: Pulverform, 250 µg/ml
in 1 ml verdünntem Puffer auflösen
Annexin-V-FITC: 100 µl, gebrauchsfertig
Färbeprozedur:
- Zellgemisch mit eiskaltem Kulturmedium (z.B. RPMI) oder PBS waschen, 5 Minuten bei
500 x g 4°C zentrifugieren
- Überstand abgießen, Zellen in eiskaltem verdünnten Puffer auf 105-106
Zellen/ml einstellen
- Zugabe von jeweils 5 µl Annexin-V-FITC und 5 µl gelöstem PJ zu
490 µl Zellsuspension
- 10 Minuten lichtgeschützt und gekühlt inkubieren
- Analyse am Durchflußzytometer bzw. Fluoreszenzmikroskop
(488 nm Exzitation, 515 nm Bandpass Filter für Fluorescein-Detektion, Filter
> 560 nm für PJ-Detektion)
- Settings FACS-Calibur:
Det.VoltageAmpGainMode
FSCE001,00Lin
SSC3501,20Lin
FL14861,00Log
FL25061,00Log
Threshold:
FSC 20
Compensation:
FL1 - 0,0% FL2
FL2 - 31% FL1

|
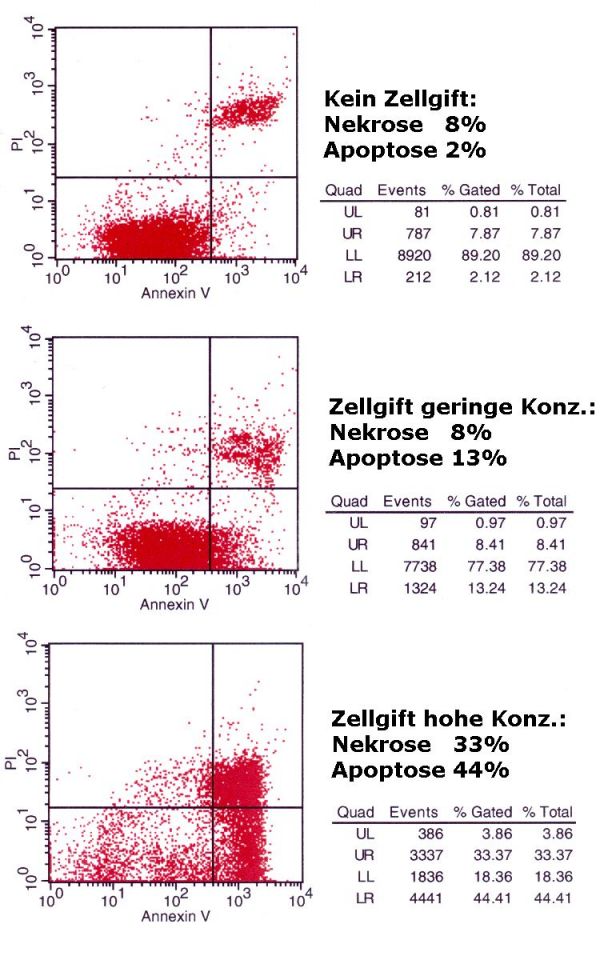
| Beispiele
von Analysen
Apoptose und Nekrose nach 24h
Einwirken von
verschiedenen Konzentrationen eines Zellgiftes |
|

|
| PI-positive
aber Annexin-negative Zellen Unter
bestimmten Bedingungen (in unserem Fall bei einer hohen Konzentration des Zellgiftes und
gleichzeitig hoher Konzentration des Antioxidans) zeigen sich auch
Propidiumiodid-positive, aber Annexin V - negative Zellen. Eine Konstellation, die es
nach dem eingangs beschriebenen Prinzip des Tests gar nicht geben dürfte.
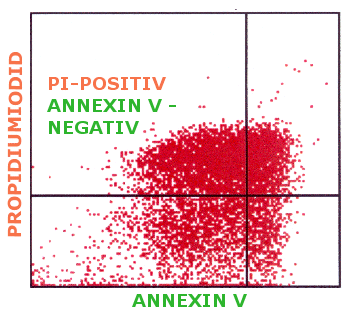
Man würde glauben, dass Zellen deren Membran für PI durchlässig
geworden ist, auch Annexin V an der Innenseite der Membranen binden müssten. Dem ist
aber offenbar nicht so. Für dieses Phänomen, das auch von anderen beschrieben worden
ist, wurden verschiedene Erklärungen vorgeschlagen. Ormerod z.B. meint, dass sich manche
Zellen einfach nicht mit Annexin V an der Innenseite anfärben. Tom Frey
hypothetisierte, dass Zellen die löchrig werden, ja nicht unbedingt gleichzeitig PI und
Annexin "hereinlassen" müssen. Sie könnten ja zuerst für PI, aber erst
später für Annexin durchlässig werden.
In jedem Fall werden diese Zellen aber zu den nekrotischen gezählt.

|
|
|
|




