AUFBAU UND FUNKTIONEN DER MILZ
|
Wo ist die Milz? Größe, Gewicht, Blutversorgung?
Die Milz befindet sich "links auf der Seite", im obersten Bereich des
Bauchraumes. Sie liegt den Rippen von innen an (siehe Abbildungen).
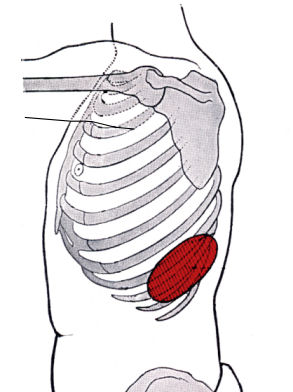 |
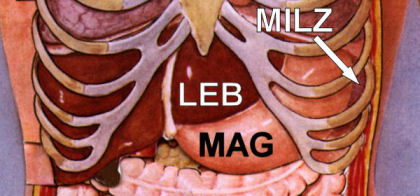
In der Abbildung links sieht man
die Milz links seitlich zwischen der 9. und 11. Rippe liegend.
Auf dem Bild oben, von vorne betrachtet, sieht man sie kaum, sie
ist größtenteils vom Magen verdeckt. |
Größe und Gewicht
Die normale Milz ist etwa 12 cm lang, 8 cm breit und 4 cm dick, das
Gewicht wird recht unterschiedlich angegeben, meist zwischen 100 und
250 g. Die Milz hat zahlreiche Hohlräume - sie wird manchmal mit einem
weichen Schwamm verglichen. Ihr Gewicht hängt wesentlich von
der Blutfülle ab.
BlutversorgungDie Blutversorgung kommt aus der Hauptschlagader,
der Aorta, über die Milzarterie. Der Blutabfluss erfolgt über die
Milzvene und Pfortader in die Leber. Etwa 360 Liter Blut fließen täglich
durch die Milz (Zum Vergleich: Blutdurchfluss der Leber ca. 2000 Liter
pro Tag).
(Oguro A., Ann Nucl Med. 1993; Yzet T.; Eur J Radiol. 2010)
|
Die wichtigsten Strukturen der Milz
Wenn man eine Milz durschneidet, ist die Schnittfläche großteils rot bis dunkelrot
(sog. rote Pulpa). Vereinzelt sieht man weiße Pünktchen (sog. weiße
Pulpa). In der roten Pulpa finden sich vorwiegend rote Blutkörperchen,
in der weißen vorwiegend weiße Blutkörperchen und zwar insbesondere
Lymphozyten.
Interessanter werden diese Dinge, wenn man den
funktionellen Aufbau der Milz betrachtet:
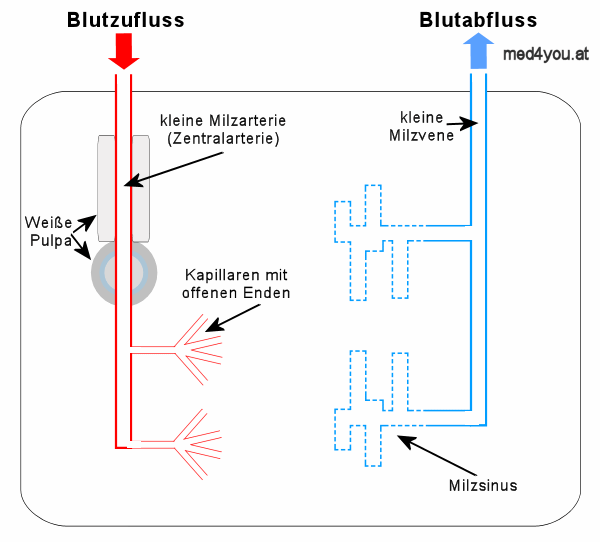 |
Milzschema
Arterien (rot) leiten Blut in die
Milz.
Die Milzkapillaren haben offene Enden.
Sie
"schütten" das Blut in von Bindegewebsfasern durchzogene
Hohlräume der schwammartigen Milz. Ein Schwamm der Blut enthält.
Dieser Bereich ist voll roter Blutkörperchen und wird rote
Pulpa genannt.
Wenn die roten Blutkörperchen wieder
aus der Milz hinaus wollen, müssen Sie in die Milzsinus
übertreten. Diese haben aber nur schmale Schlitze, durch die
sich die roten Blutkörperchen zwängen müssen.
|
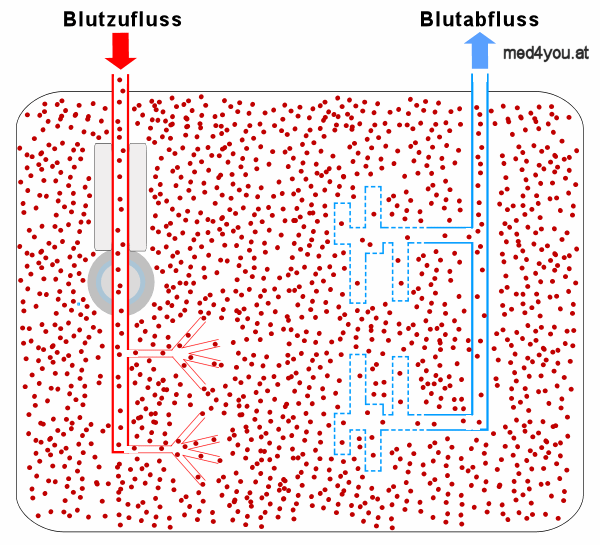 |
Schema der Milz mit roten Blutkörperchen
Weniger übersichtlich, dafür wird aber verständlich, warum diese
Areale rote Pulpa heißen.
Anmerkung: Die Blutkörperchen
in der roten Pulpa scheinen auf der Abbildung dichter als in den Arterien und
Venen. Das ist auch so, in der roten Pulpa sind die roten
Blutkörperchen konzentriert ("verdichtet"). |
Der offene Blutkreislauf der MilzDie Milz hat im Vergleich zu
den anderen Organen eine Besonderheit: ihren offenen Blutkreislauf. In
anderen Organen, wie zum Beispiel im Muskel, kommt das vom Herzen
kommende Blut über die größeren Arterien in kleinere Arterien bis es in
den ganz dünnen Kapillaren fließt. Diese Kapillaren gehen in kleinere
Venen über, diese in größere Venen und so kommt das Blut dann wieder
zurück. Es ist also ein geschlossenes Gefäßsystem. Anders in der Milz:
die Milzkapillaren sind nicht mit den Milzsinus verbunden. Die
Kapillaren schütten das Blut in durch Bindegewebe durchzogene Hohlräume
(rote Pulpa). Von dort gelangen die roten Blutkörperchen nur relativ
langsam durch enge Schlitze in die Milzsinus und von diesen in die Venen
der Milz und wieder zurück Richtung Herz. Es liegt also ein offener
Kreislauf vor, mit einer Art Zwischenspeicherung der roten
Blutkörperchen in der roten Pulpa der Milz.
Anmerkung: es wurde und wird diskutiert, ob es daneben auch einen
nennenswerten "normalen", geschlossenen Kreislauf in der Milz gibt. Der
klar dominierende Kreislauf dürfte in jedem Fall der offene sein
(Steiniger B.S., Immunology, 2015).
Die weiße PulpaWie schon weiter oben erwähnt, sieht man nach
Aufschneiden einer Milz auf
der Schnittfläche weiße Punkte. Bei mikroskopischer
Untersuchung merkt man, dass es sich um Ansammlungen weißer
Blutkörperchen handelt. Genauer gesagt vorwiegend um Lymphozyten. Diese
bilden einerseits Ummantelungen kleinerer Arterien (PALS, peri-arterial
lymphatic sheath) und andererseits kugelähnliche Gebilde
(Lymphfollikel), bis zu einem halben Millimeter im Durchmesser. Beide
Strukturen zählen zur weißen Pulpa.
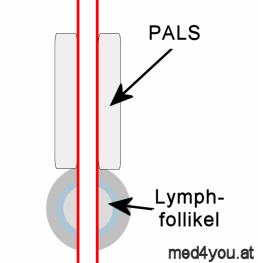 |
Weiße Pulpa der Milz
Schematisch dargestellt die
Ansammlungen der Lymphozyten in der Milz:
Einerseits als
periarterielle lymphatische Hülle (engl. peri-arterial lymphatic
sheath, PALS), die die kleine Arterie (rot) ummantelt.
Andererseits kugelige Ansammlungen - die Lymphfollikel.
In den Hüllen finden sich vorwiegend T-Lymphozyten, in den
Lymphfollikeln überwiegen die B-Lymphozyten.
Neben den Lymphozyten gibt es in der weißen Pulpa
natürlich auch eine Reihe anderer Zellen (z.B. Fresszellen =
Makrophagen, oder sog. Dendritische Zellen). Viele helfen der
Immunabwehr, bei einigen ist die genaue Bedeutung noch unklar. |
Anmerkung: wenn man sich in verschiedenen Quellen über den Aufbau
und die Funktion der Milz informiert, findet man recht
unterschiedliche Darstellungen: einmal haben die PALS eine zweite
Schicht (Marginalzone), einmal nicht. Manche beschreiben auch einen
geschlossenen Gefäßkreislauf, nicht nur einen offenen, .... Zwei Faktoren tragen zu diesen
Differenzen bei: einerseits ist tatsächlich noch manches unklar und
unerforscht, andererseits sind viele wissenschaftliche Ergebnisse und
auch graphische Darstellungen nicht von der menschlichen Milz sondern
von einer Nagetiermilz. Und der Aufbau der Milz beim Menschen
unterscheidet sich doch deutlich von dem bei Nagetieren (Steiniger B.S.,
Immunology, 2015).
 |
|
|
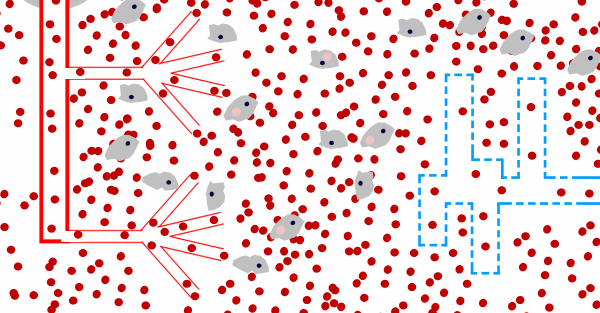
Abbau alter und defekter roter Blutkörperchen
Rote Blutkörperchen werden im Knochenmark gebildet und leben etwa 120
Tage. Etwa 1% unserer roten Blutkörperchen wird pro Tag abgebaut (Das
sind ca. 300 Milliarden rote Blutkörperchen pro Tag!). Für den Abbau ist
vor allem die Milz zuständig. Nicht nur alte, auch defekte rote
Blutkörperchen werden von der Milz entfernt.Warum die Milz so gut
zum Abbau der roten Blutkörperchen geeignet istWie weiter oben
schon beschrieben, besteht in der Milz kein geschlossener Blutkreislauf,
in dem das Blut rasch von der Arterie über die Kapillaren in die Venen
abfließt. Das Blut wird in der Milz aus offenen Kapillaren in die Räume
der roten Pulpa "geschüttet, verweilt dort einige Zeit. Und dort warten
schon Fresszellen (Makrophagen), die alte und beschädigte Blutkörperchen
fressen.
 |
|
Aus den Milzkapillaren (rot) kommen rote Blutkörperchen in die
rote Pulpa. Alte oder defekte Blutkörperchen werden von den
Fresszellen (Makrophagen; hier grau mit dunkelblauem, kleinem
Zellkern symbolisiert) aufgenommen und abgebaut bevor sie die
rote Pulpa über die Milzsinus (blau, strichliert) wieder
verlassen können. |
Außerdem kommen die roten Blutkörperchen aus den Räumen der roten
Pulpa gar nicht so leicht heraus: die Milzsinus (in der Abbildung oben
blau), über die sie wieder die Milz wieder verlassen könnten, haben keine großen
Öffnungen sondern bilden nur fallweise schmale Schlitze von maximal
0.5 µm Breite. Durch diese müssen sich die roten Blutkörperchen mühsam
durchzwängen (sie sind ja ca. 2 µm dick). Alte rote Blutkörperchen, die
nicht mehr so verformbar sind, kommen umso schwerer durch die Schlitze
und sind den Fresszellen länger ausgeliefert.
Die Sinus der Milz, genauer betrachtet
So einfach, wie
in der obigen Abbildung, ist die Wand eines Milzsinus nicht
gebaut. Die folgende Abbildung eines kurzen Abschnitts eines
Milzsinus ist schon näher an der Realität: |
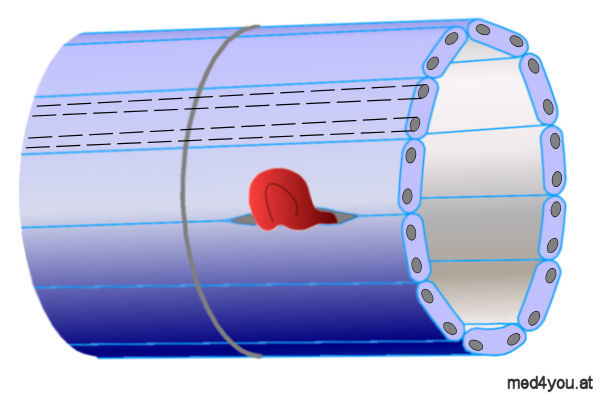 |
Die Zellen, die die Wand eines Milzsinus bilden, sind länglich
(hier horizontal dargestellt, eine Art Rohr bildend).
Zwischen den Zellen können schmale Schlitze entstehen, durch die
sich junge rote Blutkörperchen durchzwängen können. Ältere oder
defekte rote Blutkörperchen können das nicht so gut. |
Die ovalen dunkelgrauen Punkte an den Zellenden rechts sollen
Fasern darstellen, die in den Wandzellen längs laufen. In einer
Zelle ist der Verlauf dieser Fasern mit zwei strichlierten
Linien dargestellt. Diese engl. "Stressfiber" genannten
Strukturen können sich straff zusammenziehen oder "locker
lassen" und so die Breite der Schlitze zwischen den Zellen
regulieren helfen. So zumindest die Vorstellung.
Der graue
Ring von oben nach unten symbolisiert einen den Milzsinus
zusammenhaltenden Faserstrang. |
Woran erkennt die Fresszelle ein altes rotes Blutkörperchen
Obwohl die jungen Erys die rote Pulpa der Milz leichter verlassen
können, sind natürlich auch viele junge Erys in der roten Pulpa. Es wäre
schade, wenn die Fresszellen junge Erys unnötigerweise auffräßen. Es
wäre also praktisch, wenn es da ein Erkennungsmerkmal für das Alter auf
den Erys gäbe. Erstaunlicherweise weiß man auch heute noch nicht exakt,
welche Zeichen da wichtig sind. Es gibt einige Theorien dazu. Den
meisten gemeinsam ist, dass sich auf der Oberfläche der alternden Erys etwas
ändert, das Fresszellen anlockt/aktiviert. Viele favorisieren heute eine
Theorie, nach der sich bei alten Erys bestimmte Eiweißstoffe (das sog. Band
3 Protein) auf der Oberfläche so verändern, dass sich natürliche Antikörper auf die
alten Erys setzen und damit ihr Gefressen-Werden auslösen (Lutz H.U., Bogdanova
A., Frontiers in Physiology, 2013).
Welche defekten/abnormen Erythrozyten entfernt die Milz?
In der Tabelle unten finden Sie einige Erythrozyten, die die Milz
normalerweise entfernt. Diese Zellen findet man daher nur sehr selten
im Blut. Funktioniert die Milz nicht, treten diese Zellen vermehrt im
Blut auf. Manche können so als Zeichen für eine verminderte oder
fehlende Milzfunktion dienen.
 |
 |
 |
|
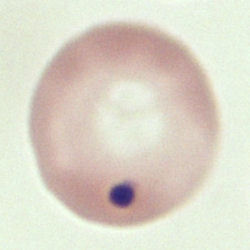
Normaler Erythrozyt zum Vergleich. Wird nur entfernt, wenn er
alt ist.
|
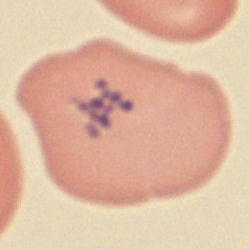
Ery mit Kernresten (Howell-Jolly-Körperchen). Reife Erys haben
keinen Kern mehr, manchmal bleiben aber Reste zurück. Näheres
weiter unten.
|
Eisenhaltige Strukturen im Ery, sog. Pappenheimer-Körperchen. |
|
|
|
|
 |
 |
 |
|
Ein sog. "Pitted" Erythrozyt. Nur mit einer Spezialoptik sind
die kraterartigen Einziehungen zu erkennen. Solche Erys sind
besonders wichtig für die Beurteilung der Milzfunktion. Näheres
weiter unten. |
Target-Zellen (= Schießscheibenzellen). |
Akanthozyten - Erys mit plumpen und unregelmäßigen Fortsätzen |
Die Milz kann Erythrozyten auch reparierenErys mit Einschlüssen
müssen nicht beseitigt werden, die Fresszellen können die Einschlüsse
auch entfernen, ohne dass der ganze Ery gefressen wird. Den Vorgang
nennt man "Pitting", was man mit "Entkernen" übersetzen könnte.
Werden die Thrombozyten (die Blutplättchen) auch in der Milz abgebaut?
Ja, aber für den Abbau der Blutplättchen spielt auch die Leber eine
bedeutende Rolle.
 |
Die Speicherung der roten Blutkörperchen, also der Erythrozyten, in der
Milz ist eine hochinteressante Funktion. Manche Tiere, z.B. Seehunde
können bis zu 50% ihrer Erythrozyten in der Milz speichern. Bei großen
Seehunden können das 20 Liter sein. Wozu? Zum Beispiel zum Tauchen. Die
Milz ist gewissermaßen die Sauerstoffflasche der Seehunde: Die
sauerstoffbeladenen Erys werden in der Milz gespeichert. Die Milz
dieser Tiere hat in ihrer Kapsel einige Muskelfasern, sie kann sich
zusammenziehen: beim Tauchen presst die Milz die Erys in der
Blutkreislauf.
Auch Hunde und Pferde können in ihrer Milz relativ
viel Blut speichern. Da dient es als eine Art Blutdoping bei großen
Belastungen (z.B. bei schnellem Laufen). Das macht absolut Sinn. In Ruhe braucht man nicht so
viele Sauerstoffträger im Kreislauf. Warum soll das Herz diese unnütz im
Kreis pumpen. Verdünntes Blut ist auch für die Gefäße schonender. Also
warum nicht die Erys in der Milz zwischenlagern. Und wenn sie dann
benötigt werden, werden sie in den Kreislauf gepresst.
|
Seehunde und
Seelöwen haben eine große Milz |
 |
Die sehr große Milz dient bei diesen Tieren als Blutspeicher
und sie hat viele Muskelfasern in der Kapsel: bei Bedarf
zieht sich die Milz zusammen und das Blut wird in den
Gefäßkreislauf gepresst. Dieser rasch verfügbare Blutvorrat
kann als Sauerstoffspeicher dienen, der beim Tauchen
verwendet wird. Links ein Seelöwe (hat Ohren). Seelöwen
haben eine etwas kleinere Milz und können nicht so lange
tauchen wie Seehunde. |
Ist diese
Funktion der Milz auch beim Menschen wichtig? Die Milz des Menschen ist
nicht so groß und hat
nicht so viele Muskelfasern in der Kapsel, um sich zu kontrahieren. Der
Mensch kann bei körperlicher Belastung nur etwa 160 ml Blut aus der Milz
in den Blutkreislauf spülen. Selbst wenn diese 160 ml konzentriertes
Blut sind (also wenig Flüssigkeit und viele Erythrozyten), wäre die
Leistungssteigerung gering.
Aber es gibt Hinweise, dass die Milz in
der Ruhephase der Nacht Erythrozyten speichert und so den Kreislauf ein
bisschen entlasten könnte. Ob das allerdings wirklich eine Herz- oder
Gefäß-schonende Wirkung hat, ist nicht klar.
(Hochachka P.W.,
Federation Proceedings, 1986; Zapol W.M., Scientific American, 1987;
Laub M., J Appl Physiol, 1993; Stewart I.B.&McKenzie D.C., Sports
Medicine, 2002)
Die Milz dient auch als Reservoir für
Blutplättchen und hilft die Thrombozytenzahl zu regulieren (Bredolan A.,
BioEssays, 2007).
|
In der weißen aber auch in der roten Milz-Pulpa befindet sich eine
große Menge von Abwehrzellen, also weiße Blutkörperchen (vorwiegend
Lymphozyten, Fresszellen und Monozyten). Dementsprechend leistet die Milz
die üblichen Aufgaben im Rahmen der Infektionsabwehr. Es werden in der
Milz Antikörper produziert, es gibt lymphozytäre Keimzentren, die sog.
Follikel, in denen Lymphozyten zu spezialisierten Abwehrzellen reifen,
und vieles mehr. So wie das in anderen lymphatischen Organen, z.B. den
Lymphknoten, auch passiert.
Besonders interessant sind aber natürlich
die Fähigkeiten der Milz, die
bei ihrem Ausfall nicht oder nicht ausreichend von anderen Organen
oder Abwehrmechanismen übernommen werden können:
Der offene
Milzkreislauf ermöglicht unseren Abwehrzellen raschen und einfachen
Zugriff auf die Erreger
Eine Besonderheit der
Milz ist ihr oben beschriebener offener Kreislauf: relativ große Blutmengen
werden aus offenen Kapillaren in den Bereich der roten Pulpa geschüttet
und umspülen die weiße Pulpa, also die Abwehrzellen. Es dürfte auch Kapillaren geben, die
direkt oder fast direkt in der weißen Pulpa enden. Damit kommen alle
Erreger, die im Blut schwimmen, sofort in direkten Kontakt mit unseren
Abwehrzellen. Die Milz kann daher besonders rasch als erste
Verteidigungslinie gegenüber im Blut schwimmenden Krankheitserregern
dienen.
Die Milz hat spezielle Bedeutung für die Abwehr von Bakterien,
die eine Kapsel besitzen
Manche Bakterien sind zum Schutz vor
unseren Abwehrzellen von einer dicken Kapsel eingehüllt. So z.B. Meningokokken, Pneumokokken und
Haemophilus influenzae. Diese Bakterien können schwere Gehirnhautentzündungen,
Lungenentzündungen und generalisierte Infektionen (Sepsis) verursachen.
Zur Bekämpfung dieser Erreger hat die Milz bestimmte Fresszellen und
bestimmte B-Lymphozyten (Näheres zu diesen B-Zellen
weiter unten). Bei
fehlender Milzfunktion können Infektionen mit diesen Erregern innerhalb
von Stunden zum Tod führen.
|
Pneumokokken (=Streptococcus pneumoniae) mit Kapsel |
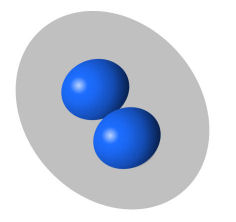 |
Links eine Symboldarstellung zweier
Pneumokokken (blaue Ovale), die um sich eine dicke Kapsel
aus Polysacchariden (~Ketten aus Zuckermolekülen) aufgebaut
haben (grau dargestellt). Die Kapsel schützt die Bakterien
vor dem Gefressenwerden durch unsere Abwehrzellen. Wir haben
aber Fresszellen und Antikörper-produzierende B-Zellen, die
auf solche Bakterien spezialisiert sind. Und diese
Abwehrzellen gibt es
vor allem in der Milz. Noch dazu filtert die Milz ja große
Blutmengen, daher ist sie für die rasche Abwehr im Blut
schwimmender Erreger sehr wichtig. |
Auch für die Abwehr von Malaria,
bei der die Erreger frei im Blut schwimmen oder in den Erythrozyten sitzen, ist die Funktion
der Milz wichtig.
(Weller S., Blood, 2004, Brendolan A, BioEssays,
2007, Kruetzmann S., J Exp Med, 2003, Mebius R.E., Nature, 2005)
|
Abbau des Hämoglobins, Speicherung von Eisen
In der Milz wird eine große Menge roter Blutkörperchen abgebaut. Deren
Bestandteile gehen aber nicht verloren. Sie werden in der Milz zerlegt
und wiederverwendet. Das Eisen der roten Blutkörperchen wird in den
vielen Fresszellen der Milz gespeichert.
Monozytenspeicher
Relativ neu ist die Erkenntnis, dass die Milz ein wichtiger Speicher für
Monozyten ist. Monozyten sind Vorläufer unserer Fresszellen und
ähnlicher Abwehrzellen. Es befinden sich in der Milz, und zwar in der
roten Pulpa, mehr Monozyten als im gesamten Blut. Bei Bedarf werden sie
rasch frei und gelangen zum Einsatzort, zum Beispiel um zerstörtes
Gewebe nach einem Herzinfarkt aufräumen zu helfen (Swirski F.K., Science,
2009).
|
|
TESTS ZUM ERKENNEN EINER VERMINDERTEN MILZFUNKTION
Da man, wie oben beschrieben, gegen eine Unterfunktion der Milz
durchaus etwas tun kann und sollte, sind nachfolgend einige Test
beschrieben, mit denen man eine Unterfunktion erkennen kann. Bei
diesen Tests wird vor allem die Hauptfunktion der Milz
getestet: die Milz soll alte/defekte Erythrozyten aufnehmen und
beseitigen. Tut sie das nicht, findet man mehr von diesen im Blut.
Nur ein Test erkennt die fehlende Abwehr-Funktion der Milz an der
Verminderung bestimmter B-Lymphozyten, der IgM-Memory-B-Zellen.
|
Erkennung einer Milzunterfunktion (=Hyposplenismus) im "ganz
normalen" mikroskopischen Blutbild
In zwei Sätzen: Milzunterfunktion hat bestimmte Merkmale im mikroskopischen
Blutbild: Vermehrung deformierter Erys (Akanthozyten), Auftreten von
Erys mit Kernresten (Howell-Jolly-Körperchen), vermehrte
Blutplättchen. Mehr als einen ersten Hinweis oder einen Verdacht auf
eine Milzunterfunktion kann das Blutbild aber nicht liefern.
Unter einem Blutbild wird im medizinischen Labor i.A. die
automatisierte Zählung (und Vermessung) der Zellen des Blutes
verstanden. Unter einem mikroskopischen Blutbild versteht
man eine Untersuchung, bei der das Blut auf einer rechteckigen,
kleinen Glasscheibe (=Objektträger) verteilt wird (Blutausstrich),
die Zellen des Blutes anschließend gefärbt und im Mikroskop
betrachtet werden.
Folgende Auffälligkeiten findet
man bei Milzunterfunktion:
Bei den Erythrozyten kommt es
zum Auftreten bzw. zu einer Vermehrung von Zellen mit Kernresten
(Howell-Jolly-Körperchen), Zellen mit schießscheibenartigem Aussehen
(Target-Zellen), Zellen mit eisenhaltigen Strukturen
(Pappenheimer-Körperchen) und Zellen mit verschieden großen, eher
plumpen Ausstülpungen (Akanthozyten). All diese Zellen kommen aber
auch bei
vielen anderen Erkrankungen vor. Selten und in minimaler Anzahl auch bei
Gesunden. Bei Milzunterfunktion sind sie jedenfalls vermehrt.
 |
Ery mit Kernresten (Howell-Jolly-Körperchen)
Reife Erys haben
keinen Kern mehr, manchmal bleiben aber Reste zurück. Diese
erscheinen als dunkel-violette bis schwärzliche, rundliche
Gebilde von 0,5 - 1.5 µm (Ery-Durchmesser ca. 7,5 µm). Beim
Gesunden extrem selten, außer beim Neugeborenen. Bei Blutarmut
mit Zerstörung der Erythrozyten (=hämolytische Anämien),
B12/Folsäuremangelanämie und bei
Chemotherapie häufiger. Und bei Milzunterfunktion. Nach
operativer Milzentfernung findet man sie nach 25 Tagen bei der
Hälfte, nach 100 Tagen bei fast allen Patienten. |
 |
Target-Zellen (= Schießscheibenzellen)
Findet man vereinzelt bei Gesunden. Neben der Milzunterfunktion
vermehrt auftretend bei Lebererkrankungen und bei manchen
Hämoglobinopathien (erbliche Erkrankungen mit abnormem roten
Blutfarbstoff). |
 |
Pappenheimer-Körperchen
Eisenhaltige Strukturen im Ery, sog. Pappenheimer-Körperchen.
Beim Gesunden extrem selten. Neben Milzunterfunktion vermehrt
vorkommend bei verschiedenen Blutarmutsformen. |
 |
Akanthozyten
Erythrozyten mit plumpen und unregelmäßigen Fortsätzen.
Neben Milzunterfunktion vermehrt bei Leberschäden, bes. bei
alkoholischen. Bei seltenen erblichen Fettstoffwechselstörungen
(Abetalipoproteinämie, Hypobetalipoproteinämie),
ev. bei erblichem Enzymmangel der Erythrozyten
(Pyruvatkinasemangel), bei Schilddrüsenunterfunktion, bei
Mangelernährung, Vitamin E-Mangel. |
Weiters kann bei Milzunterfunktion die Anzahl der weißen Blutkörperchen und
Blutplättchen erhöht sein.
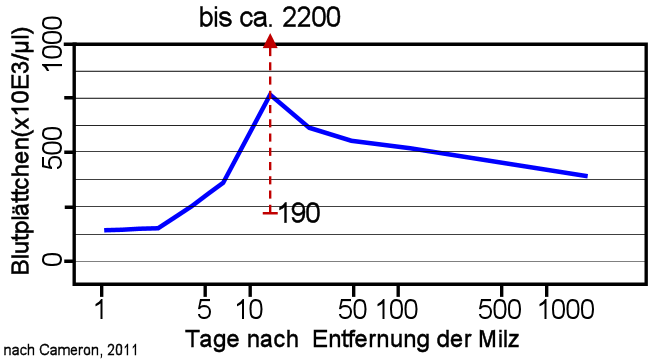 |
Anzahl der Blutplättchen nach Milzentfernung
Nach Entfernung der Milz steigen die Blutplättchen
(=Thrombozyten) im Mittel bis auf ca. 750 Tausend/µl an
(maximale Werte nach ca. 20 Tagen). Die höchsten Werte können
über 2 Millionen/µl liegen (Cameron, PLosONE, 2011; blaue
Kurve = Mittelwert aus 51 Patienten; rot der Bereich am Tag 20).
Anmerkung: Bei Gesunden mit erhaltener Milz liegen die Blutplättchen
zwischen 150 und 350 Tausend/µl. |
|
In vier Sätzen: Man entnimmt dem Patienten
Blut, schädigt die Erythrozyten durch Erhitzen und markiert die
Erythrozyten mit radioaktivem-Technetium. Dann infundiert man dem
Patienten die geschädigten, markierten Erythrozyten wieder in eine
Vene. Mit einem Detektor kann man dann über der Milz einen Anstieg
der Radioaktivität beobachten, weil die Milz die geschädigten
Erythrozyten aufnimmt. Bei Verminderung der Milzfunktion passiert
das vermindert oder gar nicht.
Die Methode sei hier
nur kurz erwähnt, es ist keine labormedizinische Methode sondern
gehört in den Bereich der Nuklearmedizin. Sie wird oft als
"Gold-Standard" verwendet um zweifelsfrei nachzuweisen ob eine
Milzunterfunktion vorliegt und wie ausgeprägt sie ist. Die Methode
ist aber sehr teuer, technisch aufwendig und bedeutet eine gewisse
Strahlenbelastung für den Patienten. Sie wird daher außerhalb von
Studien kaum durchgeführt.
|
Beurteilung der Milzfunktion durch Zählung der "Pitted
Erythrozyten"In drei Sätzen: mit einem speziellen Mikroskop erkennt man,
dass in manchen
Erythrozyten des Blutes kleine Bläschen sind, die wahrscheinlich eine Art Abfallbehälter
sind. Der Gesunde hat nur wenige solcher Erythrozyten. Bei
verminderter Milzfunktion hat man mehr, weil die Milz diese
Erythrozyten (oder nur die Abfallbläschen) eigentlich entfernen sollte.
Was sind "Pitted Erythrozyten"?
Betrachtet man Erythrozyten
in einem Mikroskop mit der sog. Nomarski-Optik bekommen sie ein
räumlicheres Aussehen. Dabei bemerkt man bei manchen Erythrozyten an der
Oberfläche kraterähnliche Vertiefungen.
 |
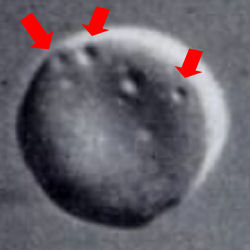
Pitted Erythrozyt
Mit Nomarski-Optik
betrachtet zeigt dieser Erythrozyt mindestens 7 erkennbare
kraterähnliche Vertiefungen. 3 sind mit Pfeilen gekennzeichnet. Ob das echte Vertiefungen
sind oder optische Effekte durch knapp unter der Oberfläche
liegende Bläschen, ist nicht ganz geklärt. Heute glaubt man eher
an den optischen Effekt. In den Bläschen dürften Abfallprodukte
sein. Wie auch immer: je schlechter die Milz funktioniert, desto
mehr von diesen Pitted Erythrozyten hat man. |
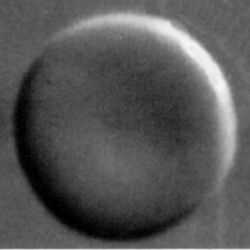 |
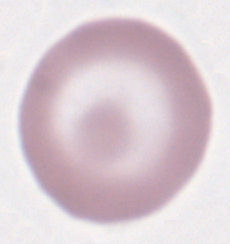
Normales rotes Blutkörperchen zum Vergleich
Bei diesem findet man keine kraterartigen Vertiefungen. |
Die kraterähnlichen Vertiefungen dürften optische Effekte
sein, die durch knapp unter der Oberfläche liegende Bläschen
entstehen. In den Bläschen dürfte sich Zellabfall befinden, der zu
beseitigen ist. Das passiert vor allem in der Milz, deren
Fresszellen entweder den ganzen Ery beseitigen oder aber das
Abfallbläschen aus dem Ery entfernen können.
Warum heißen sie
eigentlich "pitted", ist das nicht falsch?
Pitted heißt doch "entkernt", "entsteint". Das sind diese Zellen ja nicht. Sie haben
den "Kern", also das Abfallbläschen ja noch. Zwei
Erklärungsmöglichkeiten: 1. Man kann "pitted" auch mit "narbig", "körnig"
ev. sogar mit "Krater-tragend" übersetzen. 2. Erklärung: Ursprünglich
könnte mit "pitted" tatsächlich gemeint gewesen sein, dass aus dem
Ery etwas entfernt wurde und er daher nachher "pitted", also
entkernt ist: 1966
beschrieb D.G.Nathan kraterähnliche Vertiefungen, die er mit
Nomarski-Optik bei Thalassämie-Patienten fand. Bei Thalassämie kann
abnormes Hämoglobin verklumpen. Er interpretierte die beobachteten
Krater als mögliche Folge der Entfernung des verklumpten Hämoglobins. Und dafür
verwendete er das Wort "pitting". Und ein Ery mit dem das passiert
ist, ist dann "pitted" (Nathan D.G., American Journal of Medicine, 1966).
In dieser Bedeutung wäre das Wort "pitted" dann aber eine nach dem
heutigen Wissen nicht ganz korrekte Bezeichnung.
Übrigens dürfte die
Erstbeobachtung der Pitted Erythrozyten auf Koyama S. zurückgehen,
dem derartige Erythrozyten bei Patienten nach Milzentfernung
aufgefallen sind (Mie Medical Journal, 1962; Titel: "Postsplenectomy
vacuole; new erythrocyte inclusion body").
Wie zählt man Pitted Erythrozyten?
Hat man ein Mikroskop mit Nomarski-Optik, ist das nicht so schwer:
man vermengt das Blut mit einem Fixationsmittel (Glutaraldehyd),
gibt das Blut auf einen Glasobjektträger, sieht sich die
Erythrozyten im Mikroskop an und zählt normale und die Pitted
Erythrozyten.
Wann sind Pitted
Erythrozyten erhöht?
Pitted Erys sind erhöht bei allen
Erkrankungen, bei denen die Milzfunktion vermindert ist. Nach
Milzentfernung aber auch bei Erkrankungen, die die Milzfunktion
vermindern (siehe oben). Auch bei Neugeborenen und Frühgeborenen
finden sich höhere Werte.
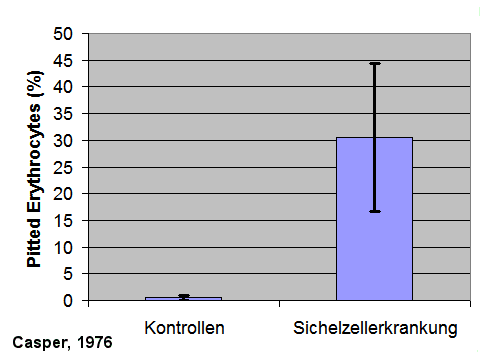
Beispiel 1: Aus einer frühen Studie von Casper
J.T., Blood, 1976. Die Milzschädigung bei Sichelzellanämie führte
zu stark erhöhten Pitted Erythrozyten (Anm.: die "Kontrollen" waren
einerseits Krankenhauspersonal und Patienten ohne Milzerkrankung mit
unauffälligem Blutbild; dargestellt: Mittelwert/Standardabweichung):
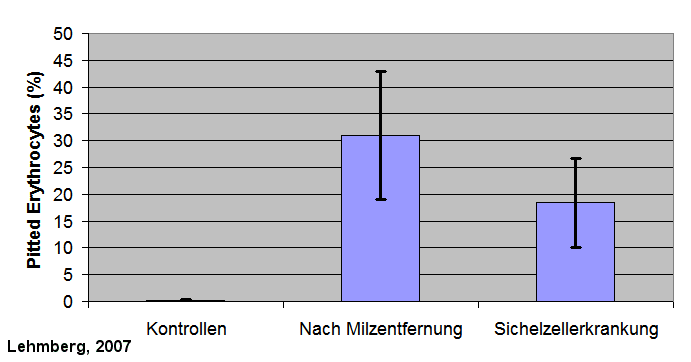
Beispiel 2: Nach einer neueren Studie bei Patienten bis zu 20 Jahren (Lehmberg
K., Klinische
Pädiatrie, 2007) Splenektomierte, also Patienten nach Entfernung der
Milz, zeigten die höchsten Werte (dargestellt:
Mittelwert/Standardabweichung):
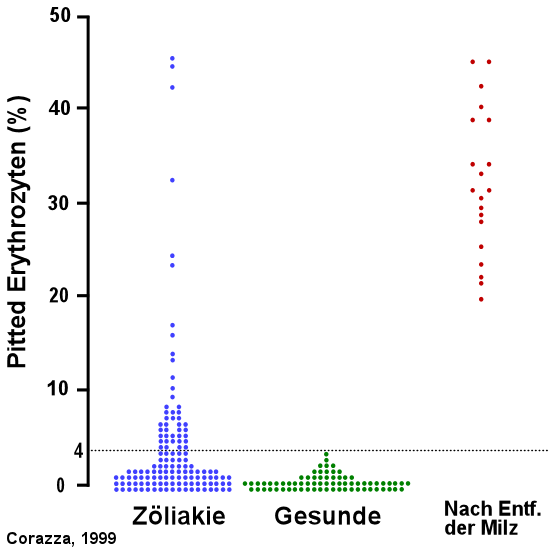
Ein interessantes Beispiel noch von Corazza G.R. (American Journal
of Gastroenterology, 1999). Er vergleicht unbehandelte, erwachsene
Zöliakiepatienten mit Gesunden und Patienten ohne Milz. Einige der
Zöliakiepatienten scheinen kaum mehr eine Milzfunktion zu haben, da
ihre Pitted Erythrozyten so hoch sind wie nach Milzentfernung. Anm.:
die punktierte Linie bei 4% sieht Corazza als obere
Normalwertgrenze:
Referenzbereiche ("Normalwerte") der
Pitted Erythrozyten
Manche sehen den Referenzbereich bzw. den Bereich bei normaler
Milzfunktion von 0-2%, andere von 0 bis 4% (Beispiele in der Tabelle
unten). Neugeborene haben etwa 5 Tage lang höhere Werte,
Frühgeborene bis zu 2 Monate (Werte bis über 20% wurden bei diesen beobachtet;
Lehmberg K., 2007).
|
Quelle |
Pitted Erythrozyten (angegeben in %) |
Kontrollpopulation (Anzahl) |
|
Casper J.T., Blood, 1976; 47(2):183 |
0,5
± 0,5 (MW±SD); Die
Werte lagen zwischen 0 - 2.6. |
Krankenhauspersonal und Pat. ohne Milzerkrankung zwischen
2 Monaten und 43 Jahren (n=88) |
|
Corazza G.R., Am J Gastroent, 1999; 94:391 |
Mittelwert 0.8%, Werte lagen zwischen 0,05 und 3.9.
SD wurde keine angegeben. |
Gesunde zwischen 16 und 68 Jahren (n=70) |
|
Lehmberg K., Klinische Pädiatrie, 2007; 219: 339 |
0,13 ± 0,29 (MW±SD); Werte lagen ca.
zwischen 0 - 1,8. |
Kinder mit verschiedenen Diagnosen aber anzunehmend normaler
Milzfunktion zwischen 1 Mo und 20 Jahren (n=90) |
|
Rogers Z.R., Blood; 2011; 117(9): 2614 |
1,1 ± 0,9 (MW±SD);
Werte lagen ca.
zwischen 0 - 3,5. |
Kinder mit Sichelzellänämie aber normaler Milzfunktion im
Tc-Scan; 8-18 Monate (n=23) |
Gibt es Grenzen, die eine Milzunterfunktion wahrscheinlich
machen? Gibt es Grenzen, bei deren Überschreitung
man etwas tun sollte?
Studien sahen eine Anzahl von über 15% bzw. 16% Pitted Erythrozyten
als Hinweis auf eine fehlende Milzfunktion an (Casper J.T, Blood,
1976, Corazza G.R., Brit Med J., 1984). Eine Studie schätzte Werte
zwischen 2 und 18% als Hinweis für eine verminderte Milzfunktion, Werte über 18%
als Hinweis für eine fehlende Milzfunktion an (Lehmberg K., Klin.
Pädiatrie, 2007). Nur eine Studie beschrieb eine fehlende
Milzfunktion bereits bei Werten über 4.5% (Rogers Z.R., Blood,
2011).
Theoretisch sollte man diese Patienten so behandeln wie Patienten
nach Milzentfernung entsprechend den weiter oben genannten deutschen
oder englischen Richtlinien. Allerdings sind in den
Richtlinien selbst keine Grenzwerte für Pitted Erythrozyten genannt.
Eine Publikation empfiehlt Impfungen ab einem Wert über 10% Pitted
Erythrozyten (Di Sabatino A., World J Gastroent, 2013).
|
Beurteilung der Milzfunktion durch Zählung der Erys mit Howell-Jolly-Körperchen
In drei Sätzen: Nur ganz wenige Erythrozyten haben noch Reste ihres Zellkerns
(die sog. Howell-Jolly-Körperchen), weil solche Zellen beim Gesunden fast
ausnahmslos von der Milz entfernt werden. Bei Milzunterfunktion hat
man mehr von diesen Zellen im Blut. Mikroskopisch ist es schwierig,
Erythrozyten mit Howell-Jolly-Körpechen verlässlich zu zählen, mit Hilfe der
Durchflusszytometrie lassen sie sich aber exakt bestimmen und
könnten ein wertvoller Parameter zu Erkennung eine Milzunterfunktion
sein.
 |
Ery mit Kernresten (Howell-Jolly-Körperchen)
Reife Erys haben
keinen Kern mehr, manchmal bleiben aber Reste zurück. Diese
erscheinen als dunkel-violette bis schwärzliche, rundliche
Gebilde von 0,5 - 1.5 µm (Ery-Durchmesser ca. 7,5 µm). Beim
Gesunden extrem selten, außer beim Neugeborenen. Bei Blutarmut
mit Zerstörung der Erythrozyten (=hämolytische Anämien),
B12/Folsäuremangelanämie und bei
Chemotherapie häufiger. Und bei Milzunterfunktion. |
Es ist schon sehr lange bekannt, dass Patienten ohne Milz
vermehrt Erys mit Howell-Jolly-Körperchen im Blut haben. Immer
wieder hat man versucht, die mikroskopische Zählung von
Howell-Jolly-Erythrozyten als Test für eine verminderte oder
fehlende Milzfunktion zu verwenden, die Ergebnisse waren aber
schlecht. Viele Studien kamen zum Schluss, dass
Howell-Jolly-Erythrozyten kein verlässlicher Indikator einer
verminderten Milzfunktion sind.
Das lag aber auch daran, dass die
Howell-Jolly-Erythrozyten mikroskopisch gezählt wurden und eine mikroskopische Zählung im Blut schwierig ist. Man erkennt Erys mit
Howell-Jolly-Körperchen zwar recht gut, aber es gibt extrem wenige.
Der Gesunde dürfte maximal nur ca. 0,004% haben. Das ist nur einer
pro 25000 Erythrozyten (Harrod V. et al., Exp Hematol, 2007). Da
wird das mikroskopische Zählen extrem aufwendig und auch zur
Glücksache.
Verlässlichere Ergebnisse kann man erzielen, wenn man
die Howell-Jolly-Erythrozyten mit speziellen Automaten, sog.
Durchflusszytometern, zählen lässt. Dazu muss man nur die
Howell-Jolly-Körperchen mit einem Fluoreszenzfarbstoff anfärben und
das Gerät kann ohne Probleme in wenigen Minuten Millionen
Erythrozyten messen und die Zahl der Howell-Jolly-Erythrozyten exakt
bestimmen.Referenzbereiche ("Normalwerte") der
Howell-Jolly-Körperchen Erythrozyten bestimmt mittels
Durchflusszytometrie
|
Quelle |
HJ-Ery (angegeben in % reifer Erys) |
Kontrollpopulation (Anzahl) |
|
Harrod V.L., Experimental Hematology, 2007; 35: 179 |
0,002 ± 0,001 (MW±SD) |
Gesunde Freiwillige (n=50, 42±11 Jahre) |
|
Rogers Z.R., Blood; 2011; 117(9): 2614 |
0,005 ± 0,006 (MW±SD) |
Kinder mit Sichelzellänämie aber normaler Milzfunktion im
Tc-Scan; 8-18 Monate (n=23) |
Gibt es Grenzen, die eine Milzunterfunktion wahrscheinlich
machen?
Laut Berechnungen von Z.R. Rogers sprechen Werte ab ca. 0,07% für
eine fehlende Milzfunktion, Harrod fand bei Sichelzellerkrankten
nach Milzentfernung im Mittel Werte von 0,21%.
Anstieg nach Milzentfernung verzögert
P.U. Cameron fand 25 Tage nach operativer Milzentfernung
mikroskopisch nur bei der Hälfte der Patienten Erythrozyten mit
Howell-Jolly Körperchen, erst nach 100 Tagen bei fast allen
Patienten. Daher muss man - auch wenn man durchflusszytometrisch
viel sensitiver misst - nach Milzentfernung oder nach plötzlichen
Veränderungen der Milzfunktion eine gewisse Verzögerung des Anstiegs
der HJ-Erys erwarten (Cameron P.U., PLos ONE, 2011).
|
Die Bestimmung der Erys mit "argyrophilen" Einschlüssen
In drei Sätzen: Färbt man Erythrozyten mit einer einfachen
Silberfärbung, dann erkennt man im Mikroskop in einigen Erys
körnerartige Strukturen. Man weiß nur teilweise, was sie
darstellen und nennt sie daher einfach nur "Silber-liebende"
("argyrophile") Einschlüsse, weil sie sich mit Silberfarbstoff
anfärben. Was man
aber weiß ist, dass es bei Milzunterfunktion mehr Erythrozyten mit
solchen Einschlüssen gibt und dass sie daher als Maß für die Milzunterfunktion
dienen können.
Hat man kein Spezialmikroskop um die "Pitted
Erythrozyten"
zu erkennen und kein Durchflusszytometer um die
Howell-Jolly-Körperchen exakt zu zählen, bliebe als Alternative, die
Milzfunktion durch Zählung der Erythrozyten mit sog. argyrophilen
Einschlüssen zu untersuchen. Dazu färbt man die Erythrozyten
des Blutes mit einer Silbernitratlösung. Betrachtet man die so gefärbten Erythrozyten in
einem ganz normalen Mikroskop, dann
sieht man in einigen Erythrozyten ein oder zwei schwarzgraue
Körner-artige Gebilde. Dabei dürfte es sich um
Howell-Jolly-Körperchen handeln, um Pappenheimer-Körperchen
(eisenhaltige Strukturen im Erythrozyten) aber auch um andere, noch
nicht identifizierte Strukturen. Das Gemeinsame all dieser
Strukturen: sie färben sich mit dem Silberfarbstoff an, man kann
sie also "Silber-liebend", "argyro-phil" nennen. Daher der Ausdruck
"argyrophile Einschlüsse".
Aber auch wenn man nicht
genau weiß, was man da alles anfärbt, weiß man, dass es bei
verminderter Milzfunktion mehr Erythrozyten mit argyrophilen
Einschlusskörpern gibt: Bei 23 Gesunden lag der Anteil solcher
Erythrozyten bei 0 bis 3,4%, bei Patienten nach Milzentfernung
zwischen 11 und 52% (Tham K.T., Am J Clin Path, 1996).
Es gibt noch wenige Studien zu dieser Methode, deswegen ist
nicht klar, ob sie wirklich eine Alternative zu den Pitted Erythrozyten
darstellen kann.
|
In drei Sätzen: man hat in der Milz eine besondere Art von Abwehrzellen
beschrieben: die sog. IgM-Memory-B-Zellen. Diese Zellen gelangen aus
der Milz auch
ins Blut und sind dort bei Milzunterfunktion vermindert. Mit Hilfe
eines Durchflusszytometers kann man sie recht einfach bestimmen und
so die Milzfunktion testen.
Die bisher beschriebenen Methoden zur Testung der Milzfunktion
haben ausschließlich die Erythrozyten-Filterfunktion der Milz
getestet: ob es die Pitted Erythrozyten sind, Erys mit
Howell-Jolly-Körperchen oder Erys mit argyrophilen Einschlüssen - all
diese Dinge sollte die rote Pulpa der Milz herausfiltern/
beseitigen. Und wenn sie das nicht tut, hat man mehr davon im Blut.
Auch der Technetium-Uptake testet letztlich diese Funktion.
Die
IgM-Memory-Zellen kommen aber aus der weißen Pulpa und haben mit der
Erythrozyten-Filterfunktion der Milz nichts zu tun.
Was ist das Besondere an IgM-Memory-B-Zellen?
Viele weiße Blutkörperchen, vor allem Lymphozyten, sind gegen bestimmte "Feinde" gerichtet.
Z.B. gegen Masern-Viren oder andere Erreger. Memory-Zellen sind Lymphozyten,
die schon einmal Kontakt mit diesem Feind
hatten. Und wenn sie solchen Kontakt hatten, sind sie noch mehr auf
ihn spezialisiert und können ihn noch besser bekämpfen, sollten sie
ihm wieder begegnen.
Die typische Memory-B-Zelle trägt an Ihrer
Oberfläche IgG-, IgA- oder selten IgE- Antikörper (das sind
bestimmte Antikörperklassen). Die IgM-Memory-B-Zelle hingegen trägt, wie der
Name vermuten lässt, IgM-Antikörper an der Oberfläche.
Und diese
IgM-Memory-B-Zellen gibt es vor allem in der Milz.
Nur für immunologisch Interessierte: Diese Zellen haben
daneben vielleicht noch andere Besonderheiten: im Gegensatz zu den
normalen Memory-B-Zellen ist ihre Entwicklung offenbar nicht von
T-Zellen abhängig und sie dürften sich nicht in den Zentren der
Lymphfollikel entwickeln sondern in der Randzone/Marginalzone um die
Follikel (Colombo M., Mol Med, 2013). Und vielleicht machen sie gar
keine somatische Hypermutation nach Antigenkontakt durch sondern
diversifizieren die Immunglobulingene durch antigenunabhängige
Mechanismen - wären dann also keine echten Memory-Zellen. Andere
sehen das ganz anders und halten die IgM-Memory-B-Zellen für relativ
normale Memory-Zellen (Seifert M., PNAS, 2015).Können die
IgM-Memory-B-Zellen auch etwas Spezielles?
Ja, sie sind nicht nur etwas anders, sie können auch Besonderes: sie
produzieren sehr rasch IgM-Antikörper gegen kapseltragende Bakterien
(Meningokokken, Pneumokokken und Haemophilus influenzae) und
helfen daher entscheidend bei deren rechtzeitiger Beseitigung mit.
Wo findet man die
IgM-Memory-B-Zellen in der Milz?
Man findet sie in der weißen Pulpa, und da wiederum in der
Randzone* der Lymphfollikel.
 |
Weiße Pulpa der Milz
Schematisch dargestellt die
Ansammlungen der Lymphozyten in der Milz:
Unten schematisch
dargestellt kugelige Ansammlungen - die Lymphfollikel.
In der Randzone* um den Lymphfollikel (dunkelgrauer Ring um
den Follikel) befinden sich die IgM-Memory-B-Zellen. |
*Ob man diese Randzone "Marginalzone"
nennen sollte, ist umstritten. Viele tun es, und die
IgM-Memory-B-Zellen werden daher oft auch als Marginalzonen-B-Zellen
der Milz bezeichnet. Spezialisten der Milzanatomie meinen, man
sollte den Ausdruck Marginalzone für diese Region um den Follikel vermeiden und empfehlen den Ausdruck Superfizialzone
(Steiniger B.S., Immunology, 2015). Dementsprechend ist auch
der Ausdruck IgM-Memory-B-Zellen passender als
Marginalzonen-B-Zellen.
Gibt es IgM-Memory-B-Zellen nur in der Milz?
Nein, man hat sie oder sehr ähnliche Zellen auch an
anderen Stellen gefunden, z.B. in den Gaumenmandeln, im
lymphatischen Gewebe des Darmes, in Lymphknoten. Aber die
IgM-Memory-B-Zellen, die man im Blut findet, stammen überwiegend aus
der Milz. Was auch dazu passt, dass sie im Blut vermindert sind,
wenn die Milz entfernt ist oder ihre Funktion eingeschränkt.
Wie bestimmt man die IgM-Memory-B-Zellen im Blut?
Wie gesagt ist
das typische an diesen Memory-B-Zellen, dass sie an der Oberfläche
IgM-Antikörper (und IgD-Antikörper) tragen. Dazu tragen sie noch das
für Memory-B-Zellen typische CD27-Antigen.
Markiert man diese Strukturen gleichzeitig mit entsprechenden fluoreszierenden
Markern an, dann kann man die Zellen recht einfach mit sog.
Durchflusszytometern erkennen und zählen.
Der Referenzbereich ("Normalwert") der IgM-Memory-B-Zellen im
Blut
Der mittlere Wert wird bei Gesunden meist zwischen 10 und 20%
angegeben, der Wertebereich ca. zwischen 5 und 40%. Beispiele in der
Tabelle. Daraus einen gültigen Referenzbereich abzuleiten, ist wegen
der niedrigen Fallzahlen schwierig.
|
Quelle |
IgM-Memory-B-Zellen (angegeben in % der B-Zellen) |
Kontrollpopulation (Anzahl) |
|
Di Sabatino A., Am J Gastroent, 2005; 100: 1788 |
Median 13,7%, Werte zwischen 6,1 und 32% |
Gesunde Freiwillige (n=13) |
|
Lammers A.J.J.J., Am J Hematol, 2012; 87: 484 |
15,5 ± 10,1% (MW±SD), Werte ca. zwischen 7 und 38% |
Gesunde Freiwillige (n=10) |
|
Sanchez-Ramon S., Clin Immunol, 2008; 128: 314 |
22,3 ± 14,5% (MW±SD), kein Wertebereich angegeben |
Gesunde Freiwillige (n=50) |
|
Di Sabatino A., Clin Gastroent Hepatol, 2006; 4: 179 |
Median 18,7%, Werte zwischen 9,7 und 36,8% |
Gesunde Freiwillige (n=35) |
Wann
findet man verminderte Konzentrationen der IgM-Memory-B-Zellen
Verminderungen der IgM-Memory-B-Zellen werden einerseits bei
Immunschwächeerkrankungen beobachtet (z.B. bei der sog. CVID oder
bei AIDS) und
andererseits bei Fehlen der Milz oder Milzunterfunktion (Liste
siehe
oben).
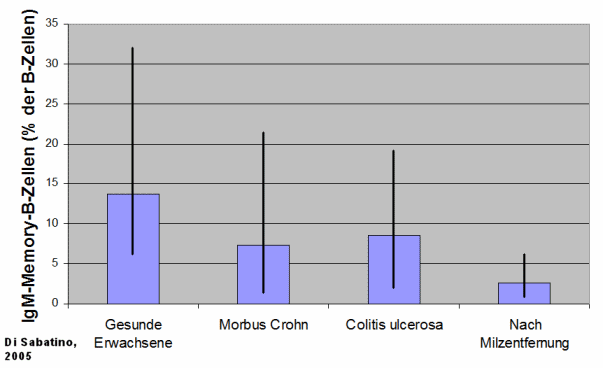
Beispiel: Aus einer Studie von Di
Sabatino, Am J Gastroent, 2005. Es fanden sich signifikant
niedrigere Prozentsätze von IgM-Memory-B-Zellen bei entzündlichen
Darmerkrankungen (Morbus Crohn, Colitis ulcerosa), die ja oft mit
einer Unterfunktion der Milz verknüpft sind. Und natürlich nach
Milzentfernung (dargestellt: Mittelwert und Wertebereich):
Ähnlich sieht es bei der Zöliakie aus, auch da sind die
IgM-Memory-B-Zellen signifikant vermindert.
Wie schnell sinken die
IgM-Memory-B-Zellen?
Der Wert sinkt in den ersten 20-30 Tagen nach Milzentfernung rasch, dann langsam
weiter etwa 6 Monate lang, bevor
er sich auf dem niedrigeren Niveau stabilisiert. Daraus folgt,
dass die IgM-Memory-B-Zellen erst ein halbes Jahr nach einer
Milzentfernung oder einer anderen plötzlichen Veränderung der
Milzfunktion eine aussagekräftige Aussage über die Milzfunktion
erlauben (P.U. Cameron, PLos One, 2011).
Hat es Konsequenzen, wenn die IgM-Memory-B-Zellen vermindert
sind?
Man nimmt an, dass die Verminderung der IgM-Memory-B-Zellen eine
erhöhte Anfälligkeit für Infektionen, insbesondere für solche
mit kapseltragenden Bakterien nach sich zieht. Das ist auch durchaus
logisch,
aber nicht so leicht eindeutig zu beweisen: Fakt ist zwar, dass man
eine erhöhte Infektanfälligkeit in Patientengruppen mit verminderter
IgM-Memory-B-Zellzahl findet. Aber nachzuweisen, dass die
verminderte IgM-B-Memory-Zellen auch die Ursache der
Infektanfälligkeit waren, ist sehr schwierig.
Kann man eine Grenze
nennen, unter der das Infektionsrisiko sehr hoch wird?
Nein, so eine Grenze wurde noch nicht
beschrieben. Die einzige m.W. in der Literatur beschriebene
Entscheidungsgrenze stammt von A. Sabatino, der bei
Zöliakiepatienten mit IgM-Memory-B-Zellen unter 10% vorbeugende Impfungen empfiehlt.
|
Andere Tests zur Beurteilung der Milzfunktion
Vereinzelt wurde in Studien versucht, die Reaktion auf Impfungen als
Parameter für die Milzfunktion heranzuziehen. Man beobachtete nach
Milzentfernung eine verminderte Produktion von Antikörpern nach
bestimmten Impfungen.
Das Tuftsin, ein Stoff der in der Milz
hergestellt wird, ist nach Milzentfernung, bei Sichelzellanämie und
bei Zöliakie im Blut vermindert. Es könnte ein einfacher Parameter
zur Beurteilung der Milzfunktion sein.
All diese Methoden haben
aber bisher keine besondere Bedeutung in der Testung der
Milzfunktion erlangt.
|
|
|
|
Ayers, A. B.; Davies, B. N.;
Withrington, P. G. (1972): Responses of the isolated, perfused human
spleen to sympathetic nerve stimulation, catecholamines and
polypeptides. British Journal of Pharmacology 44 (1), S.
17–30.
Brendolan, Andrea; Rosado, Maria
Manuela; Carsetti, Rita; Selleri, Licia; Dear, T. Neil (2007):
Development and function of the mammalian spleen. BioEssays :
news and reviews in molecular, cellular and developmental biology
29 (2), S. 166–177.
Cameron, Paul U.; Jones, Penelope;
Gorniak, Malgorzata; Dunster, Kate; Paul, Eldho; Lewin, Sharon et
al. (2011): Splenectomy associated changes in IgM memory B cells in
an adult spleen registry cohort. PloS one 6 (8), e23164.
Casper, J. T.; Koethe S.; Rodey G.E.;
Thatcher L.G. (1976): A new method for studying splenic
reticuloendothelial dysfunction in sickle cell disease patients and
its clinical application: a brief report. Blood 47 (2), S.
183–188.
Cesta, Mark F. (2006): Normal
structure, function, and histology of the spleen. Toxicologic
pathology 34 (5), S. 455–465.
Colombo, Monica; Cutrona, Giovanna;
Reverberi, Daniele; Bruno, Silvia; Ghiotto, Fabio; Tenca, Claudya et
al. (2013): Expression of immunoglobulin receptors with distinctive
features indicating antigen selection by marginal zone B cells from
human spleen. Molecular medicine (Cambridge, Mass.) 19, S.
294–302.
Corazza, G. (1999): A reassessment of
splenic hypofunction in celiac disease. The American Journal of
Gastroenterology 94 (2), S. 391–397.
Corazza, G. R.; Ginaldi L.; Zoli, G.;
Frisoni, M.; Lalli, G.; Gasbarrini, G.; Quaglino, D. (1990):
Howell-Jolly body counting as a measure of splenic function. A
reassessment. Clinical Laboratory Hematology 12 (3), S.
269–275.
Corazza, G. R.; Tarozzi C.; Vaira D.;
Frisoni M.; Gasbarrini G. (1984): Return of splenic function after
splenectomy: how much tissue is needed. British Medical Journal
289, S. 861–864.
Corazza, Gino R.; Addolorato,
Giovanni; Biagi, Federico; Caputo, Fabio; Castelli, Elena;
Stefanini, Giuseppe F.; Gasbarrini, Giovanni (1997): Splenic
Function and Alcohol Addiction. Alcoholism: Clinical &
Experimental Research 21 (2), S. 197–200.
Crary, Shelley E.; Buchanan, George R.
(2009): Vascular complications after splenectomy for hematologic
disorders. Blood 114 (14), S. 2861–2868.
Davies, John M.; Lewis, Michael P. N.;
Wimperis, Jennie; Rafi, Imran; Ladhani, Shamez; Bolton-Maggs, Paula
H. B. (2011): Review of guidelines for the prevention and treatment
of infection in patients with an absent or dysfunctional spleen:
prepared on behalf of the British Committee for Standards in
Haematology by a working party of the Haemato-Oncology task force.
British journal of haematology 155 (3), S. 308–317.
Di Sabatino, Antonio; Brunetti, Laura;
Carnevale Maffe, Gabriella; Giuffrida, Paolo; Corazza, Gino Roberto
(2013): Is it worth investigating splenic function in patients with
celiac disease? World journal of gastroenterology 19 (15), S.
2313–2318.
Di Sabatino, Antonio; Carsetti, Rita;
Corazza, Gino Roberto (2011): Post-splenectomy and hyposplenic
states. The Lancet 378 (9785), S. 86–97.
Di Sabatino, Antonio; Rosado, Maria
Manuela; Ciccocioppo, Rachele; Cazzola, Paolo; Morera, Raffaele;
Corazza, Gino Roberto; Carsetti, Rita (2005): Depletion of
immunoglobulin M memory B cells is associated with splenic
hypofunction in inflammatory bowel disease. The American Journal
of Gastroenterology 100 (8), S. 1788–1795.
Drenckhahn, D.; Wagner, J. (1986):
Stress fibers in the splenic sinus endothelium in situ: molecular
structure, relationship to the extracellular matrix, and
contractility. The Journal of Cell Biology 102, S. 1738–1747.
Engelhardt, M.; Eber, S.; Germing, U.;
Heimpe, l. H.; Kern, W. V.; Schmugge, M. (2013): Praevention von
Infektionen und Thrombosen nach Splenektomie oder funktioneller
Asplenie. Onkopedia.
Engelhardt, M.; Haas, P. S.;
Theilacker, C.; Eber, S. W.; Schmugge, M.; Kern, W. V.; Heimpel, H.
(2009): Prevention of infections and thromboses after splenectomy or
because of functional loss of the spleen. Deutsche medizinische
Wochenschrift (1946) 134 (17), S. 897–902.
Harmon, Gregory S.; Lee, John S.
(2010): Splenic atrophy in celiac disease. Clinical
gastroenterology and hepatology : the official clinical practice
journal of the American Gastroenterological Association 8 (12),
A22.
Harrod, Virginia L.; Howard, Thad A.;
Zimmerman, Sherri A.; Dertinger, Stephen D.; Ware, Russell E.
(2007): Quantitative analysis of Howell-Jolly bodies in children
with sickle cell disease. Experimental hematology 35 (2), S.
179–183.
Holroyde, C. P.; Gardner, F. H.
(1970): Acquisition of Autophagic Vacuoles by Human Erythrocytes.
Physiological Role of the Spleen 36 (5), S. 566–575.
Hsu, Chao-Yu; Chen, Hsuan-Ju; Hsu,
Chung Y.; Kao, Chia-Hung (2016): Splenectomy increases the
subsequent risk of systemic lupus erythematosus. Rheumatology
international 36 (2), S. 271–276.
Kent, G.; Minick, O. T.; Volini, F.
I.; Orfei, E. (1966): Autophagic vacuoles in human red cells.
American Journal of Pathology 48 (5), S. 831–857.
King, H.; Shumacker, H. B. (1952):
Splenic studies. I. Susceptibility to infection after splenectomy
performed in infancy. Annals of Surgery 136 (239-242).
Kirkineska, L.; Perifanis, V.;
Vasiliadis, T. (2014): Functional hyposplenism. Hippokratia
18 (1), S. 7–11.
Kristinsson, Sigurdur Y.; Gridley,
Gloria; Hoover, Robert N.; Check, David; Landgren, Ola (2014):
Long-term risks after splenectomy among 8,149 cancer-free American
veterans: a cohort study with up to 27 years follow-up.
Haematologica 99 (2), S. 392–398.
Lammers, A. J. Jolanda; de Porto,
Alexander P N A; Bennink, Roelof J.; van Leeuwen, Ester M M;
Biemond, Bart J.; Goslings, J. Carel et al. (2012): Hyposplenism:
comparison of different methods for determining splenic function.
American journal of hematology 87 (5), S. 484–489.
Lehmberg, K.; Steinhausen, B.; Janka,
G. (2007): From neonates to adolescents--the diagnostic significance
of pitted erythrocytes in hyposplenic and asplenic children.
Klinische Padiatrie 219 (6), S. 339–342.
Lipson, R. L.; Bayrd, E. D.; Watkins,
C. H. (1959): The postsplenectomy blood picture. American Journal
of Clinical Pathology 32 (6), S. 526–532.
Lutz, Hans U.; Bogdanova, Anna
(2013): Mechanisms tagging senescent red blood cells for clearance
in healthy humans. Frontiers in physiology 4, S. 387.
Martinez-Gamboa, Lorena; Mei, Henrik;
Loddenkemper, Christoph; Ballmer, Boris; Hansen, Arne; Lipsky, Peter
E. et al. (2009): Role of the spleen in peripheral memory B-cell
homeostasis in patients with autoimmune thrombocytopenia purpura.
Clinical immunology (Orlando, Fla.) 130 (2), S. 199–212.
Mebius, Reina E.; Kraal, Georg (2005):
Structure and function of the spleen. Nature reviews. Immunology
5 (8), S. 606–616.
Mellemkjøer, Lene; Olsen, Jø Rgen H.;
Linet, Martha S.; Gridley, Gloria; McLaughlin, Joseph K. (1995):
Cancer risk after splenectomy. Cancer 75 (2), S. 577–583.
Misra, Durga Prasanna; Jain, Vikramraj
K.; Negi, Vir Singh (2016): Splenectomy increases the subsequent
risk of systemic lupus erythematosus: a word of caution.
Rheumatology international 36 (2), S. 277–278.
Morris, D. H.; Bullock, F. D. (1919):
The importance of the spleen in resistance to infection. Annals
of Surgery 70 (5), S. 513–521.
Nathan, D. G.; Gunn, R. B. (1966):
Thalassemia: the consequences of unbalanced hemoglobin synthesis.
American Journal of Medicine 41, S. 815–830.
Owunwanne, A.; Halkar, R.; Al-Rasheed,
A.; Abubacker, K. C.; Abdel-Dayem, H. (1988): Radionuclide imaging
of the spleen with heat denatured technetium-99m RBC when the
splenic reticuloendothelial system seems impaired. The Journal of
Nuclear Medicine 29, S. 320–323.
Pivkin, Igor V.; Peng, Zhangli;
Karniadakis, George E.; Buffet, Pierre A.; Dao, Ming; Suresh, Subra
(2016): Biomechanics of red blood cells in human spleen and
consequences for physiology and disease. Proceedings of the
National Academy of Sciences of the United States of America 113
(28), S. 7804–7809.
Porto, A.P.N.A. de; Lammers, A. J. J.;
Bennink, R. J.; ten Berge, I J M; Speelman, P.; Hoekstra, J. B. L.
(2010): Assessment of splenic function. European journal of
clinical microbiology & infectious diseases : official publication
of the European Society of Clinical Microbiology 29 (12), S.
1465–1473.
Prasad, Ganapathy A.; Wang, Kenneth
K.; Lutzke, Lori S.; Lewis, Jason T.; Sanderson, Schuyler O.;
Buttar, Navtej S. et al. (2006): Frozen section analysis of
esophageal endoscopic mucosal resection specimens in the real-time
management of Barrett's esophagus. Clinical gastroenterology and
hepatology : the official clinical practice journal of the American
Gastroenterological Association 4 (2), S. 173–178.
Ravaglia, G.; Forti, P.; Biagi, F.;
Maioli, F.; Boschi, F.; Corazza, G. R. (1998): Splenic function in
old age. Gerontology 44 (2), S. 91–94.
Rogers, Zora R.; Wang, Winfred C.;
Luo, Zhaoyu; Iyer, Rathi V.; Shalaby-Rana, Eglal; Dertinger, Stephen
D. et al. (2011): Biomarkers of splenic function in infants with
sickle cell anemia: baseline data from the BABY HUG Trial. Blood
117 (9), S. 2614–2617.
Shephard, Roy J. (2016): Responses of
the human spleen to exercise. Journal of sports sciences 34
(10), S. 929–936.
Steiniger, Birte S. (2015): Human
spleen microanatomy: why mice do not suffice. Immunology 145
(3), S. 334–346.
Stewart, Ian B.; McKenzie, Don C.
(2002): The Human Spleen During Physiological Stress. Sports
Medicine 32 (6), S. 361–369.
Swirski, Filip K.; Nahrendorf,
Matthias; Etzrodt, Martin; Wildgruber, Moritz; Cortez-Retamozo,
Virna; Panizzi, Peter et al. (2009): Identification of splenic
reservoir monocytes and their deployment to inflammatory sites.
Science (New York, N.Y.) 325 (5940), S. 612–616.
Tham, K. T.; Teague, M. W.; Howard, C.
A.; Chen, S. Y. (1996): A Simple Splenic Reticuloendothelial
Function Test: Counting Erythrocytes With Argyrophilic Inclusions.
American Journal of Clinical Pathology 105, S. 548–552.
Viviers, Petrus J. (2014): A case of
thoracic splenosis in a post-splenectomy patient following abdominal
trauma: Hello Howell-Jolly. Oxford medical case reports 2014
(5), S. 93–95.
Weledji, Elroy P. (2014): Benefits and
risks of splenectomy. International journal of surgery (London,
England) 12 (2), S. 113–119.
Weller, Sandra; Braun, Moritz C.; Tan,
Bruce K.; Rosenwald, Andreas; Cordier, Corinne; Conley, Mary Ellen
et al. (2004): Human blood IgM "memory" B cells are circulating
splenic marginal zone B cells harboring a prediversified
immunoglobulin repertoire. Blood 104 (12), S. 3647–3654.
|
|
|
|








