| MED4YOU |
 |
LABORBEFUNDE |
 |
TECHNIKEN |
 |
AUTOMATISATION |
 |
|
|||||||
|
AUTOMATISATION in der Labormedizin |
| Wesentliche Trends in der Labormedizin In der Labormedizin sind in den letzten drei Jahrzehnten in folgenden Bereichen Verbesserungen erzielt worden:
Die Analysegeräte und Methoden wurden immer sensibler. Dadurch wurden einerseits die zur Analyse benötigte Probenmengen immer kleiner und andererseits auch der Nachweis von Stoffen in sehr geringer Konzentrationen möglich (Endokrinologie, Toxikologie).
Dadurch kann gezielt nur der gesuchte Stoff bestimmt werden, ohne Störung durch ähnliche Stoffe. Der entscheidende Durchbruch gelang dabei durch die Einführung enzymatischer und immunologischer Methoden.
Damit wird allgemein auch die Vergleichbarkeit und Reproduzierbarkeit der Ergebnisse besser. Die Resultate hängen nicht mehr so sehr vom Personal und dessen Erfahrung ab.
|
||||||
Warum die Mechanisierung unaufhaltsam fortschreitet
Die heute übliche Befundpalette von 20 - 50 Parametern pro Blutabnahme hätte noch vor 20 Jahren einen unzumutbaren "diagnostischen Aderlass" bedeutet. Mechanisierte Analysen benötigen geringere Probenmengen. Zudem bringt der Übergang zum Mikrolitersystem enorme Einsparungen bei den Reagenzien und damit den Kosten.
Bei der Erstellung von Blutbildern beispielsweise musste früher mittels Pipettierschlauch und Mundstück Blut angesaugt werden. Bei den heutigen Analysensystemen in der Hämatologie müssen die Röhrchen nicht einmal mehr entstoppelt werden! Verringerung der Verwechslungsgefahr von Probe und Reagenz durch Einsatz von Barcode-codierten Primärröhrchen (Primärröhrchen sind die Röhrchen, in die das Blut des Patienten bei der Blutabnahme abgenommen wurde). Mittels Barcodeleser erfolgt nicht nur Probenidentifzierung, sondern auch die Reagenzidentifizierung der barcodierten Reagenzfläschchen, als auch die Positionserkennung der Probe im Probengestell. Befunde werden über Jahre gespeichert und können innerhalb von Sekunden abgerufen werden. Außerdem kann die steigende Datenflut (Patienten-, Analysen-, QC-, Statistik-, Kostendaten) und Dokumentationspflicht nur noch durch den EDV-Einsatz bewältigt werden.
|
||||||
Anforderungen
an Analysensysteme
|
||||||
| Wie sind mechanisierte
Analysensysteme aufgebaut? Die Qualität der mechanischen Ausstattung ist für die Lebensdauer der Geräte entscheidend!
|
||||||
| Unterschied zwischen Automat und mechanisiertem
Analysensystem Bei der Mechanisierung werden einzelne Handgriffe maschinell durchgeführt, während bei Automaten zur Vollmechanisierung noch die Selbststeuerung hinzukommt. Automaten sind daher Vorrichtungen, in denen ein bestimmter Arbeitsprozess programmgesteuert oder selbsttätig geregelt und damit vom Menschen weitgehend unabhängig ausgeführt wird. In einzelnen Teilbereichen steuern sich moderne Analysegeräte selbst, z.B. Temperaturkontrolle oder Wasserzulauf, während die Qualitätskontrolle nicht automatisiert werden soll. Für die Bedienung eines Automaten ist keine qualifizierte Ausbildung notwendig.
|
||||||
| Wie erfolgt die Probenzufuhr? Entweder werden die Blutabnahmeröhrchen (=Primärröhrchen) selbst in das Gerät gestellt, was Probenvertauschungen vermeidet, oder Probe aus dem Primärröhrchen wird in ein Kunststoffcup (Sekundärgefäß) übertragen.
Die Anordnung der Proben (Primärröhrchen oder Cups) kann auf einem Karussell oder in linearen Gruppen geordnet sein. Bei Verwendung von Probencups werden, zum Schutz vor Verdunstung und Verunreinigungen, die Gefäße bei manchen Geräten mit Deckeln verschlossen, die bei der Entnahme durchstoßen werden. In den meisten Fällen werden diese Gefäße nach einmaligem Gebrauch verworfen. 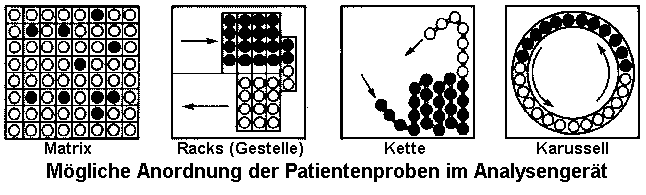
|
||||||
| Wie erfolgt die Probenidentifikation? Allgemein üblich ist im Spital heute die Verwendung von Barcodes zur Identifikation der Patientenproben. Die Erfassung der Proben kann maschinell erfolgen, z.B. mit einem Barcodeleser, womit eine erhöhte Sicherheit bei der Zuordnung von Analysenergebnis und Probe erzielt wird. Die vom Lesegerät ermittelte Information wird im Computer des Automaten gespeichert und nach Ablauf der Analyse den Ergebnissen zugeordnet. Im allgemeinen müssen an einer Probe mehrere Messmethoden angewendet werden, die Probe muss somit für die einzelnen Analysengänge aufgeteilt werden. Bei der händischen oder maschinellen Aufteilung der Probe müssen die Teilmengen eindeutig gekennzeichnet sein um später die Ergebnisse dem richtigen Patienten sicher zuzuordnen.
|
||||||
| Wie erfolgt der Probentransport im Gerät? Durchflussprinzip Die flüssigen Proben und Reagentien werden mittels Proportionierpumpen durch ein Schlauchsystem gepumpt. Mehrere Walzen wandern hintereinander über Schläuche und pressen diese von außen zusammen, wodurch der Inhalt kontinuierlich fortbewegt wird. Das transportierte Volumen wird durch die Geschwindigkeit der Walzenbewegung und den Innendurchmesser des Pumpschlauches bestimmt.Werden die Proben im Schlauchsystem durch Luft- oder Flüssigkeitssegmente voneinander getrennt, spricht man von einem segmentierten (inkohärenten) Transport. Die Segmentierung durch Luftblasen erfüllt einen doppelten Zweck: Sie reduziert Verschleppungseffekte und fördert die Durchmischung von zusammenfließenden Lösungen in den Mischschlangen. Die Zeit der Continuous-Flow Messgeräte ist aber praktisch vorüber.
Diskreter Transport von Proben erfolgt in separaten Einzelgefäßen: pro Probe ein Gefäß.
Vorteile des diskreten Transports gegenüber dem
Durchflussprinzip: |
||||||
| Wie arbeiten diskrete Analysensysteme? Jede Reaktion verläuft in einer eigenen Messküvette, d.h. kein Transfer zwischen Inkubation und Messung. Die Messküvetten werden in den meisten Geräten mehrmals verwendet und müssen deshalb gewaschen werden. Pipettoren und Dilutoren werden mehrmals verwendet. Wie gesagt, erfolgt bei den diskreten Analysengeräten der Probentransport in separaten Einzelgefäßen. Streng genommen gibt es keine diskreten Analysengeräte, denn schon bei mehrfacher Verwendung einer Pipette, Dispensors oder Dilutors findet der Probentransport teilweise kontinuierlich statt. Man sollte daher von gemischt diskret-kontinuierlichen Geräten sprechen.
|
||||||
| Was bedeutet sequentiell, was batch-parallel? Werden die Proben nacheinander analysiert, so spricht man von sequentieller Bearbeitung. Methodenselektiv bedeutet, dass man die Methode auswählen kann und patientenselektiv, dass alle Bestimmungen pro Patient abgearbeitet werden und ein Patient folgt dem nächsten. Bei sequentiell überlappender Probenbearbeitung werden mehrere verschiedene Reaktionen gleichzeitig, zeitlich versetzt, durchgeführt. Dieses time-sharing bringt enorme Zeitersparnis und damit eine Erhöhung des Probendurchsatzes. Die erhaltenen Signale werden im Computer des Analysensystems zum Ergebnis verarbeitet und anschließend ausgedruckt bzw. an die Labor-EDV weitergeleitet. Batch-parallel: Viele gleiche Bestimmungen verschiedener Proben werden gleichzeitig durchgeführt, also eine gruppenweise Probenabarbeitung. 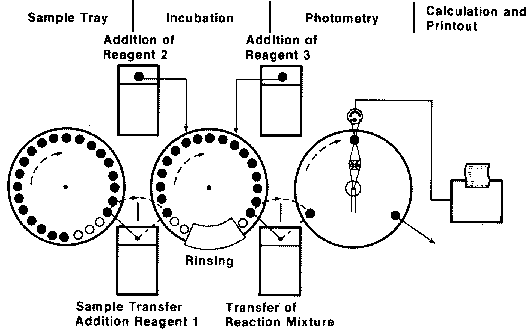 |
||||||
| Random
Access Analyser bearbeiten einen Patienten nach dem anderen. Die einzelnen Patientenproben werden patientenselektiv abgearbeitet, bevor der nächste Patient bearbeitet wird.
|
||||||
| Was
sind Einkanal- und Mehrkanalgeräte? Bei der simultanen Probenbearbeitung werden, wie schon erwähnt, immer alle Parameter bestimmt. Hämatologiesysteme liefern jedesmal ein komplettes Blutbild (rote und weiße Blutkörperchen, Blutplättchen,..), auch wenn nur Blutplättchen angefordert sind. Dies ist zwar unökonomisch hinsichtlich Verbrauch von Reagenzien, Probenvolumen und Gesamtanalysendauer, ist jedoch durch das starre Programm einfacher zu bewerkstelligen.
|
||||||
| Was versteht man unter Analysen- und
Probenfrequenz? Die Kapazität
der Analysengeräte wird mit den beiden Begriffen Analysenfrequenz und Probenfrequenz
charakterisiert. Die Analysenfrequenz ergibt sich aus Probenfrequenz mal Anzahl der
Kanäle.
|
||||||
| Womit wird Flüssigkeit dosiert zugegeben? Eine Möglichkeit ist die Mechanisierung des
Übertragungsvorganges mit einer Kolbenpumpe. In der Verbindungsleitung zwischen der
Kolbenpumpe und der Übertragungskanüle befindet sich Luft als Kopplungsmedium.
|
||||||
| Wie wird der Reaktionsansatz gemischt? Die einwandfreie und schnelle Mischung von Probe
und Reagenzien ist besonders bei der Zugabe der Startsubstanz wichtig, weil man nur bei
gleichmäßiger Verteilung der Komponenten einen einwandfreien Ablauf der Reaktion
erwarten kann.
|
||||||
Wie arbeiten Zentrifugalanalyser?
Damit kann die Extinktion mehrfach während des Reaktionsablaufes gemessen werden. Mit diesem Rotor ist es möglich, eine Bestimmungsart gleichzeitig bei einer größeren Zahl an Proben durchzuführen. Dieses Gerät ist daher für die gruppenweise, batchweise Verarbeitung größerer Serien geeignet.
|
||||||
| Aufbau und Aufgaben des Photometers im
Analysengerät
|
||||||
| 2. Extinktionsmessung des Ansatzes vor und nach der
Reaktion bei: Substrat-Bestimmungen nach dem Endwert-Verfahren. 3. Messung der Extinktionsänderung des Ansatzes während eines festen Zeitintervalls bei der Substanz-Bestimmung auf kinetischer Basis. Technik der photometrischen Messung Das Photometer eines Analyseautomaten muss sehr kleine Extinktionsänderungen zuverlässig erfassen können: Bei enzymatischen Reaktionen treten oft nur sehr geringe Extinktionsänderungen auf; so entspricht z.B. bei den Aminotransferasen 1 U/l etwa D E/D t = 1x10-3/min. Die Photometerqualität wurde bei modernen Automaten bereits soweit gesteigert, dass Extinktionsänderungen in der Größenordnung von 1x10-4/min reproduzierbar gemessen werden können. In der Praxis wird die Präzision der Messung sehr geringer Extinktionsänderungen durch die optische Unruhe des Analysenansatzes begrenzt. Diese kommt u.a. durch Verunreinigung im Ansatz, vor allem durch Trübungen in der Probe, zustande. Wie wird aus Licht elektrischer Strom? Wozu dienen A/D-Wandler und warum werden Signale
digitalisiert? |
||||||
| Welche Vorteile haben in Analysengeräten durchgeführte
photometrische Methoden? In Analysensystemen werden bei jeder Methode Lichtintensitäten gemessen, in Extinktionswerte umgewandelt und anschließend nach dem passenden Methodenprogramm in die gesuchten Konzentrationswerte umgerechnet. Gegenüber manuellen Methoden besteht bei der Durchführung von Analysen auf mechanisierten Geräten die Möglichkeit der Überwachung des Reaktionsablaufes und der nachfolgenden Auswertung durch die Geräte-EDV (=Computer im Analysensystem). Bei vielen Analysensystemen wird vor der Probenzugabe die Leerwertextinktion (Blank) des Reagenz an 2 Zeitpunkten gemessen. Aus diesen beiden Messwerten kann das System erkennen ob der Reagenzleerwert innerhalb vorgegebener Grenzen liegt. Weiterhin wird bei Analysensystemen überprüft, ob sich die beiden Extinktionswerte ändern. Dies würde auf das Ablaufen einer Störreaktion hinweisen. Nach Zugabe der Probe und Ablauf der Reaktionszeit, die in den Analysensystemen auch Totzeit genannt wird, werden wieder 2 Extinktionswerte gemessen. Aus der Konstanz dieser beiden Extinktionswerte kann das System erkennen, ob die Reaktion im Gleichgewicht ist. Dieser Extinktionswert ist von den Schwankungen der Lichtintensität der Photometerlampe unabhängig. |
||||||
Wichtige Hinweise: Die Website kann
Ihnen nur einen allgemeinen Überblick bieten und Orientierungshilfe sein. Allgemeine
Informationen können Ihren Arzt nicht ersetzen, da nur er Ihre individuelle Situation
beurteilen kann. Anregungen für Verbesserungen, Ergänzungen oder interessante Themen
nehmen wir gerne an, individuelle Anfragen können leider nicht beantwortet werden. Alle
Angaben erfolgen ohne Gewähr. Die in med4you dargestellten Informationen dürfen auf keinen Fall als Ersatz
für professionelle Beratung oder Behandlung durch approbierte Ärzte angesehen werden.
Der Inhalt von med4you kann und darf nicht zur Diagnosestellung oder zum
Durchführen von Behandlungen verwendet werden. Bitte Nutzungsvereinbarungen lesen. Reproduktionen
gleich welcher Art, die über die private Nutzung hinausgehen, nur mit schriftlicher
Genehmigung der Redaktion. Impressum.
|